Bienvenue sur le site d'astronomie de Romain Pittin.
Spectroscopie Partie théorique
7. Fluorescence et mécanique des raies.
Les luminescences
La luminescence est une émission de rayonnements électromagnétiques par un mécanisme non thermique. La lumière émise par les vers luisants, par les souches pourrissantes, est une luminescence.
La luminescence est produite en deux temps : excitation puis émission. On distingue deux formes différentes : la fluorescence et la phosphorescence :
· la fluorescence :
l’émission est presque immédiate après l’excitation (délai de l’ordre de 10-8 s) ;
elle ne dépend pratiquement pas de la température ;
· la phosphorescence :
l’émission se produit de quelques dizaines de secondes à plusieurs jours après l’excitation ;
elle dépend fortement de la température.
Lorsqu’un atome est excité, l’électron peut retomber spontanément vers un état métastable (relativement stable). Il reste alors dans cet état jusqu’à ce qu’un petit apport d’énergie le ramène sur un état instable, d’où il retombe en émettant un photon. C’est le mécanisme de la phosphorescence. Les mécanismes sont expliqués ci-dessous.
La fluorescence est un phénomène produisant un spectre de raies : il ne contient que certaines longueurs d’onde bien particulières, et rien ailleurs.
Ces lois sont empiriques, elles décrivent et synthétisent les résultats des expériences. Il faut maintenant expliquer ces résultats. Tournons-nous donc vers la structure des atomes, et voyons d’abord de quoi est fait le plus simple d’entre eux.
Fluorescence
La fluorescence est un phénomène produisant un spectre de raies : il ne contient que certaines longueurs d’onde bien particulières, et rien ailleurs.
l’atome d’hydrogène
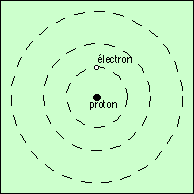
Le noyau de l’atome est constitué d’une seule particule, nommée proton. Le proton possède une charge électrique unitaire positive.
Un électron (autre particule portant une charge électrique unitaire négative, et 1.840 fois plus légère), est lié par l’attraction électrostatique au proton autour duquel il tourne (attraction entre charges de signes opposés, répulsion entre charges de même signe).
Ce modèle planétaire de l’atome d’hydrogène a été proposé par Niels Bohr au début du XXe siècle.
Contrairement aux planètes, qui peuvent circuler à n’importe quelle distance de leur étoile, l’électron n’a à sa disposition que des orbites bien particulières. La plus proche du noyau est appellée orbite fondamentale, ou de niveau 1. La seconde est de niveau 2, etc. Entre les orbites de niveau 1 et 2, il n’y en a pas d’autres possibles.
Chaque orbite est caractérisée par une certaine valeur de l’énergie, qui est d’autant plus grande que l’orbite est plus loin du noyau.
Dans la figure ci-dessous, l’électron est sur l’orbite fondamentale, de plus basse énergie. Il y est donc stable, comme un pendule est stable en position verticale (plus basse énergie potentielle).
L’électron se trouve donc normalement sur l’orbite fondamentale. Il peut passer sur une autre orbite plus éloignée (d’énergie supérieure), à condition qu’on lui fournisse l’énergie correspondant à la différence d’énergie entre les deux niveaux.
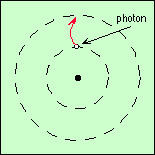
Cette énergie peut lui être communiquée par des chocs avec d’autres atomes, par un champ électrique, ou bien par un photon dont la couleur correspond à cette énergie (figure ci-contre ; rappelez-vous que l’énergie d’un photon est proportionnelle à sa fréquence, donc à sa couleur). Dans ce dernier cas, le photon est absorbé.
C’est là l’origine des raies d’absorption.
Puisque les orbites basses sont de moindre énergie que les orbites hautes, elles sont plus stables. L’électron aura donc toujours tendance à retomber vers une orbite basse. Mais son énergie diminue donc.
Pour assurer la conservation de l’énergie, il émet un photon dont la couleur est exactement celle qui correspond à la différence d’énergie entre les deux orbites.
C’est l’origine des raies d’émission.
Puisque les orbites basses sont de moindre énergie que les orbites hautes, elles sont plus stables. L’électron aura donc toujours tendance à retomber vers une orbite basse. Mais son énergie diminue donc.
Pour assurer la conservation de l’énergie, il émet un photon dont la couleur est exactement celle qui correspond à la différence d’énergie entre les deux orbites.
C’est l’origine des raies d’émission.
Puisque les raies d’émission et d’absorption correspondent à des transitions dans les deux sens entre les mêmes niveaux d’énergie, elles ont nécessairement la même couleur. On peut dire aussi que la même raie pourra se manifester en émission ou en absorption selon les circonstances.
Lorsqu’un atome est fortement excité, l’électron passe sur une orbite haute en sautant les orbites intermédiaires. Ensuite, pour se désexciter, il a la possibilité de retomber sur toute orbite de niveau inférieur. Il peut donc retomber sur une orbite proche, en émettant un photon de longueur d’onde correspondante, puis de là retomber encore à un autre niveau inférieur, jusqu’à revenir au niveau de base. Il va donc effectuer une cascade en émettant un photon à chaque saut. On observera alors autant de raies d’émission qu’il y a de niveaux dans la cascade :
l’électron retombe sur le niveau d’où il provient, on parle de fluorescence de résonance
Les raies qui constituent cette fluorescence sont nommées raies de résonance
Pourquoi des raies d’absorption ?
Le mécanisme que nous venons de voir pour expliquer les raies d’absorption pose un problème : l’absorption se fait lorsqu’un photon ayant la bonne énergie touche l’atome. L’électron est expédié sur une orbite plus haute, instable (à cause de l’énergie plus grande). Il va donc retomber spontanément vers l’orbite plus basse, en émettant un photon de même énergie, de même couleur. Par conséquent, un photon a été absorbé, un photon identique émis, donc il n’y a pas de perte, et il ne devrait pas y avoir de raie d’absorption !
Considérons une expérience qui mette en jeu ce phénomène.
On voit que le photon absorbé venait vers l’observateur, alors que le photon réémis se dirige dans n’importe quelle direction ! On n’a alors que très peu de chances pour que le photon émis prenne la même direction que le photon absorbé. Les raies d’absorption s’expliquent ainsi, bien que le nombre de photons réémis soit égal au nombre de photons absorbés.
Tout ce que nous venons d’exprimer à propos de l’atome d’hydrogène se transpose pour n’importe quel autre élément. Mais l’atome d’hydrogène est le plus simple de tous. Précisons que le noyau d’un atome quelconque est constitué de protons et de neutrons. Les raies sont dues aux influences électriques de ces particules.
Lorsqu’un électron est excité (placé sur une orbite haute), il va retomber spontanément sur une orbite plus basse. Le temps qu’il passe sur l’orbite haute est très bref, et pendant ce temps-là il n’arrive en général rien à l’atome. La transition peut donc se produire et la raie est émise.
Emission et absorption
Ces deux phénomènes sont basés sur le même mécanisme d’excitation-désexcitation des atomes. Ils sont donc très proches. Pourtant, leurs manifestations sont pratiquement opposées. Une précision s’impose.
Pour produire une émission, il faut exciter l’atome (lui fournir l’énergie de la transition). Bien sûr, l’absorption d’un photon peut fournir l’énergie nécessaire. Mais ce n’est pas la seule possibilité. Dans un milieu chaud, et assez dense, comme certaines nébuleuses, les atomes sont agités par l’énergie thermique, et s’entrechoquent. L’énergie cinétique dissipée lors du choc est tout à fait capable d’exciter, et même parfois d’ioniser, ces atomes. Il n’est donc pas forcément nécessaire d’envisager une absorption pour provoquer l’émission.